
|
| 淄博市中心医院药学通讯2018年第3期(总第111期) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
本 期 目 录
一、华法林的药理学特点及患者教育1. 华法林药学特点 1.1口服胃肠道吸收迅速而完全,生物利用度高达100%。吸收后与血浆蛋白结合率达98%~99%,能透过胎盘,母乳中极少。主要分布在肺、肝、脾和肾组织中,由肝脏代谢,代谢产物由肾脏排泄。单次服药后12~18h起效,36~48h达抗凝高峰,维持3~6d,t1/2约37h。由于本品系间接作用抗凝药,半衰期长,连续给药5~7d后疗效才可稳定,因此,维持量足够与否务必观察5~7d后方能定论。 1.2 维生素K拮抗剂的药理作用 肝脏在合成凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ及蛋白C和蛋白S等的过程中,需要维生素K,因此以上凝血因子又称为维生素K依赖凝血因子。维生素K依赖凝血因子的前体,需经过羧基化后才能转变为具有正常生物活性的凝血因子。完成羧基化的条件除二氧化碳、氧分子及羧基化酶等外,还需要还原型维生素K作为辅因子参与该过程。羧基化过程使凝血因子前体特定部位的若干谷胺酰残基经羧基化,转化为γ-羧基谷氨酸。γ-羧基谷氨酸能够结合Ca2+,凝血因子通过γ-羧基谷氨酸-Ca2+桥与磷脂表面结合,从而加速血液凝固。γ-羧基谷氨酸形成过程中,还原型维生素K转化为环氧型维生素K。正常情况下,环氧型维生素K经维生素K环氧化物还原酶的作用,转化为维生素K,再经维生素K还原酶转化为还原型维生素K供体内循环利用。香豆素类药物可竞争性抑制维生素K环氧化物还原酶,从而阻断体内维生素K循环利用过程,致使体内还原型维生素K缺乏,凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ前体不能正常羧化为具有凝血活性的因子。香豆素类药物对于肝脏已经合成的凝血因子无抑制作用,需要等待凝血因子浓度降低才会发挥作用。凝血因子Ⅶ、Ⅸ、Ⅹ、Ⅱ半衰期分别约6h、24h、40h、60h,因此服用药物后需2~3d开始发挥抗凝作用,停药2~5d后这些凝血因子浓度恢复正常,药物的抗凝作用才消失。 1.3 INR升高后如何处理? 附表 国际标准化比值(INR)异常升高或出血时的处理
(1)停用华法林(INR2.0~3.0)后,大约需要4d INR才能恢复至正常水平。 (2)INR中度升高(4.0~10.0),口服维生素K11.0~2.5mg,可在24h内使升高的INR迅速下降。多数患者静脉注射维生素K1可使INR在6~8 h内明显下降,在12~24 h内恢复正常。 (3)肌内注射维生素K1,1~2h起效,3~6h止血效果明显,12~14h后凝血酶原时间恢复正常。 2. 口服华法林患者出院后的用药管理 2.1 服药方法 华法林应于每日固定时间服用,饭前饭后均可。忘记服药之后4h内请当时补上,超过4h请勿补服,第二天继续正常用药,不能因为忘记服药而在第二天加倍。如果连续2天没有服药请联系医生或药师。 2.2 定期监测凝血功能 华法林起效慢,用药剂量个体差异大,疗效易受诸多因素影响,常通过定期监测凝血功能尤其是INR来判断治疗是否达标和指导剂量调整。INR一般稳定维持在2~3之间。出院后监测抗凝指标的间隔为每周一次,平稳后可改为每2周一次,而后每月一次,可逐渐加长时间间隔,但最好不要超过3个月。化验无需空腹。检查结果出来后咨询医生。若环境、饮食、身体状况发生变化,可根据情况及时监测。 2.3 食物、药物及生活对华法林的影响: (1)食物对华法林的影响。可以降低华法林抗凝作用的食物有:菠菜、白菜、胡萝卜、西红柿、西兰花、蛋黄、红花油、鱼肝油、豆类、海藻类、鳄梨、醋栗、动物肝脏、绿叶蔬菜(包心菜、生菜等)、肥肉、绿茶。可以增强华法林抗凝作用的食物和中药饮片有:柚子、大蒜、番木瓜、丹参、当归、银杏、人参、甘草、黄连、黄柏等。患者不必偏食或禁食某种食物,应该尽量保持饮食结构的平衡,不要盲目改变饮食结构、添加营养品,勿暴饮暴食,并定期监测凝血酶原时间(PT)和INR。 (2)药物对华法林的影响。能增强抗凝作用的药物有:抗菌药物罗红霉素、克拉霉素、莫西沙星;抑酸药西咪替丁;非甾体解热镇痛药阿司匹林;抗心律失常药胺碘酮。能减弱抗凝作用的药物有巴比妥类药物等。若患者在治疗过程中需要联合药物治疗,应告知医生正在服用华法林,不应在无医师或药师的指导下私自购买药品,尤其患者出现牙痛、感冒等常见疾病时,切勿自行购药服药,以免引起出血等严重不良反应。 (3)烟酒的影响。服用华法林的患者应尽量戒烟和避免酗酒。吸烟和饮酒会加快华法林的代谢,使抗凝效果下降。 二、含碘对比剂使用注意事项随着血管造影和经皮冠状动脉介入治疗(PCI)技术的发展,含碘对比剂(简称碘对比剂,也称造影剂)的使用越来越广泛,其安全使用和合理选择也日益受到关注。 1. 碘对比剂的分类 碘对比剂基本结构是含3个碘的苯环(3-乙酰-2,4,6-三苯甲酸)。根据苯环的个数分为单体和双聚体,按照是否在溶液中电离出离子分为离子型和非离子型,按照渗透压分为高渗、低渗和等渗对比剂。 碘对比剂的发展经历了从离子型到非离子型、从高渗到相对低渗直至等渗的过程。高渗对比剂不良反应相对较多,现已很少使用。目前临床常用的碘对比剂以等渗或低渗对比剂为主。 附表 常用碘对比剂的分类和理化性质
2. 碘对比剂的理化特点 碘对比剂的理化特性主要是分子结构、渗透压、粘稠度、亲水性、稳定性等。离子型碘对比剂属于盐剂,电离成阴离子和阳离子,以离子状态存在,可能影响机体电离环境和电解质平衡。非离子型对比剂不属于盐剂,不电离,以分子状态存在,不带电荷,水溶性好,弥散力强,低渗透压、低化学毒性、低黏度,对机体生理过程影响少。 从化学结构上看,非离子型造影剂与离子型造影剂的相同之处是它们都具有同样的苯环,苯环的2,4,6-三个位置上有三个碘原子。不同之处是非离子型造影剂在苯环的1,3,5-三个位置上引入多个羟基(OH),使得亲水性的羟基分布于苯环的周围,将疏水性的碘苯基团屏蔽于其中(大大增加了化合物的水溶性和副作用)。从理化性质上看,非离子型造影剂与离子型造影剂的不同之处是,非离子型造影剂具有水溶性大,且在水中不电离,黏稠性小,渗透压低等优点。从临床应用上看,非离子型造影剂的副反应的发生率和严重程度均明显低于离子型造影剂,可用于各部位血管造影、尿路造影和CT增强检查等。 造影剂的理化性质包括渗透压、粘滞性、水溶性、稳定性等。渗透压高容易出现不良反应,如血管内皮损伤、损害血脑屏障、血栓形成、心动过缓、新生儿水电解质失调、脊髓造影时可致蛛网膜炎等。已知渗透压大小与单位体积中溶质的颗粒数成正比,离子型较非离子型、单体较二聚体的渗透压高。离子型单体为高渗对比剂,其渗透压高达血浆渗透压的5~7倍;低渗对比剂包括非离子型单体和离子型二聚体,其渗透压明显低于高渗对比剂,但高于血浆渗透压2倍左右;等渗对比剂为非离子型二聚体,其渗透压与血浆渗透压相等。 碘对比剂的粘滞性较高,会导致通过导管注射对比剂的阻力相应增加,损伤微循环。血液的黏度为4 mPa·s,常用对比剂的粘滞性如下图。分子越大,粘滞度越高;浓度越高,粘滞度越高;温度越低,粘滞度越高。 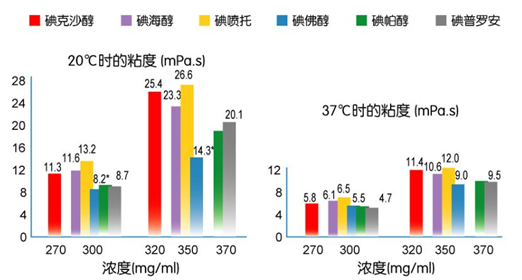
理想的造影剂应具有良好的水溶性,离子型造影剂靠正负离子与水分子正负极相互吸引,非离子型造影剂借助羟基的电极与水分子的电极相互吸引。造影剂的亲脂性基团很容易与机体蛋白、生物膜起作用而发生生物毒性,亲水性可提高化学分子的生物相容性。分子中的羟基可以包裹住疏水性的碘原子,增加水溶性,增强对比剂在尿液的排泄,降低对比剂毒性。通常来说,分子中羟基数目越多,分布越均匀,水溶性越好,不良反应越少。 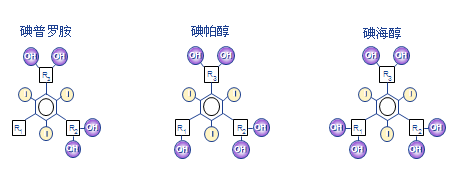
3. 使用碘对比剂前的准备工作 3.1过敏试验 原则上不推荐进行碘对比剂过敏试验,除非产品说明书注明特殊要求。因为碘对比剂过敏试验没有预测过敏样不良反应发生的价值(过敏试验结果呈阴性的患者也可能发生过敏样反应,相反,结果呈阳性的患者也不一定会发生过敏样反应),甚至其本身也可以导致严重的不良反应发生。 3.2对比剂处理 碘对比剂存放必须符合产品说明书要求,做到避光。使用前建议加热到37℃,并放置在恒温箱中。因为在37℃时,碘对比剂的黏度较低(较低于37℃而言),这样不仅便于对比剂注射,同时可以提高患者的局部耐受性。 3.3水化 根据患者个体情况进行充分的水化,有利于减少碘对比剂对患者肾损伤。水化可以增加肾血流量;降低肾素血管紧张素系统的活性;降低对比剂相关的血液粘滞度和渗透性;等渗性生理盐水可扩充血管内容积;用碳酸氢钠可使肾小管内液体碱性化,降低肾小管损害。 4.对比剂肾病 碘对比剂的使用可以引起急性肾损伤,称为对比剂诱导急性肾损伤(contrast-induced acute kidney injury,CIAKI),特别是肾功能受损患者,具有内皮功能不全的患者,糖尿病患者和没有充分水化的患者发生风险升高。CIAKI一般定义为除外其他因素,对比剂使用后血清肌酐水平与基线相比升高25%或0.5mg/dl(44μmol/L)。CIAKI在一般人群中的发生率较低,为0.6%~2.3%。但在具有危险因素的患者中,CIAKI的发生率会显著升高,例如在肾小球滤过率(GFR)<45ml/min的人群中经静脉使用对比剂后CIAKI的发生率可高达5%~20%。CIAKI在大多数患者中只是一过性的损伤,但是,CIAKI也可能引起严重的后果,发生院内并发症包括死亡的概率升高,并且可能引起远期肾功能不全。 CIAKI虽然具有重要的临床意义,但是其发生机制目前仍未被完全阐明。CIAKI的潜在机制包括直接细胞毒性的作用,自分泌和旁分泌因子干扰了肾血流动力学,流变学特性改变影响了肾血流动力学和肾小管动力学,以及局部组织缺氧。其中,肾髓质的缺氧可能是CIAKI发生的关键机制。 防治CIAKI的措施包括:①选择低渗或等渗对比剂,低渗和等渗对比剂的肾安全性比较高。②术前充分评估患者的风险/获益比。eGFR降低是CIAKI发生最重要的预测因素,推荐用eGFR评估患者的基础肾功能。除eGFR以外,年龄、心功能状态、糖尿病史、合并低血压等也与CIAKI的风险增加有关,建议应用风险评估工具结合上述变量综合评估CIAKI风险。③根据患者个体情况进行充分水化。水化是目前公认的唯一可有效预防或减少CIAKI发生的方法,对于中高危患者[eGFR<60ml/(min·1.73m2)]更应注意充分水化。④CIAKI属于剂量依赖性的非特异性不良反应,应根据患者基础肾功能和整体临床情况,在满足成像和诊断的前提下,使用最小剂量的碘对比剂。 5.对比剂的过敏反应 过敏样反应常常发生于皮肤、心血管、呼吸和胃肠系统,其中最常见的是皮肤反应,多为急性发作。急性过敏样反应轻者可能只表现为局限性的荨麻疹、瘙痒,重者可能会出现弥漫性颜面和喉头水肿、支气管痉挛和呼吸困难,发生过敏性休克甚或呼吸心脏骤停,应及时救治。几乎所有危及生命的对比剂不良反应发生在对比剂注射后20分钟内。迟发性过敏样反应大部分是常见的皮肤反应,大多数发生于注射后3h~2d内。过敏样反应可按以下推荐的分类系统对其严重程度进行分级:(1)轻度:局限性荨麻疹/瘙痒,局限性皮肤水肿,局限性咽喉“发痒”或“刺痒”,鼻充血,喷嚏/结膜炎/流涕。(2)中度:弥漫性荨麻疹/瘙痒;弥漫性红斑,但生命体征稳定;颜面部水肿,无呼吸困难;咽喉部发紧或声音嘶哑,无呼吸困难;哮鸣/支气管痉挛,无缺氧或轻度缺氧。(3)重度:弥漫性水肿或颜面部水肿伴呼吸困难,弥漫性红斑伴低血压,喉头水肿伴喘鸣和(或)缺氧,哮鸣/支气管痉挛伴显著缺氧,过敏性休克(低血压+心动过速)。血管内给予碘对比剂后急性过敏样反应的发生频次是难以精确确定的,因为患者的合并症、合并的药物治疗、焦虑等也都可能会引起类似的症状与体征。 低渗对比剂急性不良反应的发生率很低,并且大部分急性不良反应并非危及生命的。静脉内注射低渗对比剂发生严重急性不良反应很罕见,历史数据显示每10000次大约会发生4例(0.04%)。迟发型过敏样不良反应的报告发生率为0.5%~14%。一些证据表明与非离子型单体对比剂相比,等渗双聚体碘对比剂引起的迟发型皮肤不良反应发生率较高。 碘对比剂过敏反应的防治包括预防和治疗。对于高危人群(既往有碘对比剂过敏史)可考虑预防用药,但迄今为止的研究表明,能从预防用药中获益的主要是一些轻度的且不需要医疗干预或仅需轻度干预的不良反应。对于既往有碘对比剂过敏史的患者,也可以尝试换用不同成分的非离子型碘对比剂,但目前并无证据表明此方法可以有效预防不良反应的再次发生,因此因谨慎考虑。推荐的预防用药有甲泼尼龙、氢化可的松、苯海拉明等。 治疗方面,非离子型碘对比剂的大部分不良反应是轻度的、非危及生命的,通常仅需要观察、消除患者疑虑和/或对症处理。重度及危及生命的不良反应则较为罕见且无法预测。碘对比剂过敏样反应的治疗与同等程度的过敏反应的治疗是相同的。一旦发生不良反应,需要立即停止注射对比剂,并迅速评估患者的状况和不良反应严重程度,从而采取不同的处置和治疗措施。虽然严重过敏样反应发展迅速且凶险,但如能及时有效地救治一般不会导致严重后果。大多数重度过敏样反应都需要肾上腺素治疗,而合理的治疗取决于每种特定反应的临床表现。 三、关于头孢曲松(罗氏芬)说明书中去皮试的探讨药品说明书是载明药品的重要信息的法定文件,是选用药品的法定指南。新药审批后的说明书,不得自行修改,但需要根据药品上市后的信息不断更新完善。头孢曲松(罗氏芬)药品说明书自2006年11月26日核准后,共修改过9版。 1. 头孢曲松(罗氏芬)说明书中关于皮试部分的修改 关于头孢曲松皮试部分的说明,在2013年01月22日修改的说明书版本之前并没有明确要求做过敏试验,但在此版中添加关于皮试的要求,即在【注意事项】警惕部分“给药前需进行过敏试验。与其它头孢类抗生素一样,本品也有过敏反应致死的报道,即使病人不知道是过敏或之前有用药。”该部分内容在2013年11月07日修改的版本中仍继续留存。但在2015年07月16日版本的说明书中做出了修改:【注意事项】警惕部分“本品应在专业的医师指导下给药,且医院能对过敏反应采取急救措施。使用本品前,需详细询问病史,询问要有针对性,包括青霉素类、头孢菌素类、其他任何药物过敏史、过敏体质(如是否有过敏性休克,过敏性哮喘,过敏性鼻炎,麻疹等疾病病史)、家族史等。对于有过敏史特别是对药物过敏史的患者应谨慎使用本品,关于药物禁用请参见禁忌部分。有青霉素过敏性休克者不宜用头孢菌素类药物。用药后,尤其首次用药的30分钟内留院严密观察,如发现过敏性休克及时予以紧急处理。与其它头孢菌素类抗生素药物一样,本品也有过敏反应致死的报道,即使患者过敏史不详或曾经使用本品情况不详。” 2. 添加药品皮试要求的原因 遵照《关于贯彻实施23号局令统一药品批准文号工作的通知》,国家食品药品监督管理总局药品注册司公布《化学药品说明书目录》以及统一的规范说明书样稿,要求各药品生产企业根据公布的说明书样稿修订本企业产品的说明书。注射用头孢曲松钠的说明书范本即包括在《第二批化学药品说明书目录》中,在注意事项部分明确列出“给药前需进行过敏试验”,基于此,上海罗氏制药有限公司按照要求,对于本企业产品“罗氏芬”(注射用头孢曲松钠)的中文说明书按照颁布的说明书范本进行了修订,而罗氏芬(注射用头孢曲松钠)在国外的说明书并没有此项要求。 3. 删除药品皮试要求的原因 头孢菌素类的母核为β-内酰胺并合氢化噻嗪环,其结构相对稳定,β-内酰胺环也不易破裂。β-内酰胺环和氢化噻嗪环在降解时极易分解,不能形成类似于青霉噻唑基那样稳定的头孢噻唑基,而是形成多种分子碎片,这些碎片不能与蛋白质或多肽等以共价键结合形成稳定、有效的抗原决定簇。虽然目前多认为头孢菌素的主要抗原决定簇是以头孢菌素C-7位侧链R,结构为主的衍生物,但经深入的研究发现,头孢菌素分子中的各个部位都有形成抗原决定簇的可能性,即其抗原决定簇具有多样性。 引发头孢类抗菌药物过敏反应的半抗原-主要决定簇与次要决定簇尚不明确,皮试符合率<30%,使皮试方法缺乏准确性、灵敏性和特异性。目前并没有循证医学证据,证明皮试对头孢菌素类产品的过敏反应,特别是过敏性休克有足够的预测作用。2010版《中华人民共和国药典》的《临床用药须知》中至今仍无明确规定头孢菌素类药物需要皮试。而欧美国家目前也均无头孢类药物用药前皮试的要求。日本亦已于2004年经过严谨调研和科学论证后全面取消了对使用抗生素(包括头孢菌素)前进行皮试的推荐内容。同时,罗氏芬的国外说明书中,均无皮试要求。 4. 国内关于头孢类抗生素皮肤过敏试验的相关指南 2018年7月26日浙江省医院药事管理质控中心、浙江省微生物与免疫学会、浙江省护理质控中心组织医、药、护等多学科专家,结合国内外文献指南,撰写《浙江省头孢菌素类抗生素皮肤过敏试验指导意见》。主要内容如下: 4.1基本原则 ①本指导意见所指的头孢菌素类抗生素包括第一代、第二代、第三代,第四代头孢菌素类以及头孢菌素类复方制剂,并适用于头霉素类、氧头孢烯类抗生素; ②《中华人民共和国药典-临床用药须知(2015年版)》及《抗菌药物临床应用指导原则(2015年版)》未规定头孢菌素类抗生素使用前需进行皮试; ③医护人员在使用头孢菌素类抗生素前,应注重对患着及其家族过敏史的询问,包括过敏药物、食物及过敏时的临床表现等,并详细记载于病历中; ④因青霉素或头孢菌素皮试有增加患者过敏,甚至出现严重过敏反应的风险,不宜采用青霉素皮试或头孢菌素皮试筛查患者是否为过敏体质; ⑤头孢菌素类抗生素皮试对过敏性休克等严重速发型过敏反应的预测作用循证证据不充分,且阳性率远高于过敏性休克等严重速发型过敏反应的实际发生率,因此不推荐在使用头孢菌素类抗生素前进行皮试普遍筛查; ⑥医护人员在头孢菌素类抗生素皮试和使用期间,应注意密切观察患者状态,如发生皮疹、心慌、胸闷、呕吐、呼吸急促等过敏现象,及时予以相应处理,必要时立即停药,同时填写“药品不良反应报告表”; ⑦鉴于不同侧链头孢菌素不一定存在交叉过敏,皮试阳性的患者不应在病史记录中笼统表达为“头孢菌素类抗生素过敏”,应具体记录其品名如为“头孢xx(受试药物化学名)皮试阳性”。 4.2有以下情况者需皮试: ①药品说明书明确要求进行皮试的; ②既往有明确β-内酰胺类抗生素速发型过敏反应史的患者; ③既往有头孢菌素过敏史的患者,因临床情况确需使用时,应尽量选用化学结构侧链差异大的其他头孢以减少或避免交叉过敏反应的发生,而且使用前应用拟用药品做皮试;皮试和使用前应知情告之并请患者填写相关知情同意书。 5. 小结 《浙江省头孢菌素类抗生素皮肤过敏试验指导意见》明确提出不推荐在使用头孢菌素类抗生素前进行皮试普遍筛查。注射用头孢曲松钠(罗氏芬)的说明书几经修改,最终舍弃了对于皮肤过敏试验的要求。分析其根本原因在于皮肤过敏试验对于严重过敏反应的预测缺乏准确性、灵敏性和特异性,意义不大,同时阳性结果也会影响药物选择。 四、骨质疏松症及抗骨质疏松药物骨质疏松症(osteoporosis,OP)是最常见的骨骼疾病,是一种以骨量低,骨组织微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性骨病。骨质疏松症可发生于任何年龄,但多见于绝经后女性和老年男性。骨质疏松症分为原发性和继发性两大类。原发性骨质疏松症包括绝经后骨质疏松症(Ⅰ型)、老年骨质疏松症(Ⅱ型)和特发性骨质疏松症(包括青少年型)。 骨质疏松症初期通常没有明显的临床表现,但随着病情进展,骨量不断丢失,骨微结构破坏,患者会出现骨痛,脊柱变形,甚至发生骨质疏松性骨折等后果。骨质疏松性骨折(或称脆性骨折)指受到轻微创伤或日常活动中即发生的骨折,是骨质疏松症的严重后果。骨质疏松性骨折的常见部位是椎体、髋部、前臂远端、肱骨近端和骨盆等,其中最常见的是椎体骨折。 骨质疏松症的诊断主要基于双能X线吸收检测法(dualenergy X-ray absorptiometry,DXA)骨密度测量结果和/脆性骨折。对于绝经后女性、50岁及以上男性,建议参照WHO推荐的诊断标准,基于DXA测量结果(见附表1):骨密度值低于同性别、同种族健康成人的骨峰值1个标准差及以内属正常;降低1~2.5个标准差为骨量低下(或低骨量);降低等于和超过2.5个标准差为骨质疏松;骨密度降低程度符合骨质疏松诊断标准,同时伴有一处或多处脆性骨折为严重骨质疏松。骨密度通常用T-值(T-Score)表示,T-值=(实测值-同种族同性别正常青年人峰值骨密度)/同种族同性别正常青年人峰值骨密度的标准差。基于DXA测量的中轴骨(腰椎1-4、股骨颈或全髋)骨密度或桡骨远端1/3骨密度对骨质疏松症的诊断标准是T-值≤-2.5。脆性骨折是指受到轻微创伤或日常活动中即发生的骨折。如髋部或椎体发生脆性骨折,不依赖于骨密度测定,临床上即可诊断骨质疏松症。 附表1 基于DXA测定骨密度分类标准
抗骨质疏松症药物按作用机制可分为骨吸收抑制剂、骨形成促进剂、其他机制类药物及传统中药见附表2。 附表2 防治骨质疏松症主要药物
1. 双膦酸盐(bisphosphonates) 该类药物是焦磷酸盐的稳定类似物,其特征为含有P-C-P基团(图1),是目前临床上应用最为广泛的抗骨质疏松症药物。双膦酸盐与骨骼羟磷灰石的亲和力高,能够特异性结合到骨重建活跃的骨表面,抑制破骨细胞功能,从而抑制骨吸收。目前用于防治骨质疏松症的双膦酸盐主要包括阿仑膦酸钠、唑来膦酸、帕米膦酸钠、利塞膦酸钠、伊班膦酸钠、依替膦酸二钠和氯膦酸二钠等。
图1双膦酸盐类药物化学结构式 双磷酸盐的分子结构特征决定了抑制骨重吸收的强度,具体表现在以下两个方面:(1)双膦酸盐类化合物的基本结构P-C-P键是其产生抑制骨重吸收活性的必要条件。药物分子中磷酸根上的氧原子能与钙离子螯合形成二配位体而发挥活性,同时膦酸基团的存在,也有助于药物向细胞内转运。(2)双膦酸盐药物分子P-C-P结构碳原子上的取代基R1和R2的不同决定了其药效强度的大小。①R1主要参与双膦酸盐与骨基质中的羟基磷灰石的结合,决定了双膦酸盐在体内能否迅速而选择性地结合到骨矿物表面。目前临床上应用的双膦酸盐药物的R1一般为-OH,相应的双膦酸盐与钙鳌合形成三配位体,增强了双膦酸盐与骨矿化基质结合的亲和力。②R2的侧链结构对双膦酸盐抗骨吸收的性质起着决定性作用。研究发现:1)侧链的长短对双膦酸盐的活性起着重要作用。药物转运扩散需要一定的水溶性和脂溶性。一个适宜的碳链长度可增强化合物的脂溶性,提高药物的稳定性和生物利用度。帕米膦酸钠和阿伦膦酸钠结构相似,但因阿伦膦酸钠R2侧链较长,其抗骨吸收强度是帕米膦酸钠的10倍。但不能无限地延长侧链,当延长至一定程度,侧链的增加会减弱双磷酸盐的强度。2)侧链中含有氮原子,可显著增加双磷酸盐活性。含伯胺基的双膦酸盐比不含伯胺基的抗骨重吸收强100倍以上,若将胺基烷基化或引入含氮杂环,其抗骨重吸收能力将进一步提高,含仲胺或叔胺的双膦酸盐是目前已开发出最强的骨吸收抑制剂。如R2侧链的N上引入甲基和戊基得到的伊班膦酸钠,其活性比依替膦酸钠强1万倍;若R2上的H原子被咪唑甲基取代得到唑来膦酸钠的强度为依替膦酸钠的2万倍。 双膦酸盐类药物总体安全性较好,主要不良反应有胃肠道不良反应、一过性“流感样”症状、肾脏毒性、下颌骨坏死、非典型股骨骨折等。 2. 降钙素(calcitonin) 降钙素是一种钙调节激素,能抑制破骨细胞的生物活性、减少破骨细胞数量,减少骨量丢失并增加骨量。降钙素类药物的另一突出特点是能明显缓解骨痛,对骨质疏松症及其骨折引起的骨痛有效。目前应用于临床的降钙素类制剂有两种:鳗鱼降钙素类似物和鲑降钙素。降钙素总体安全性良好,少数患者使用后出现面部潮红、恶心等不良反应,偶有过敏现象,可按照药品说明书的要求,确定是否做过敏试验。鉴于鼻喷剂型鲑降钙素具有潜在增加肿瘤风险的可能,鲑降钙素连续使用时间一般不超过3个月。 3. 绝经激素治疗(menopausal hormone therapy,MHT) 该类药物能抑制骨转换,减少骨丢失。临床研究已证明MHT包括雌激素补充疗法(estrogen therapy,ET)和雌、孕激素补充疗法(estrogen plus progestogen therapy,EPT),能减少骨丢失,降低骨质疏松性椎体、非椎体及髋部骨折的风险,是防治绝经后骨质疏松症的有效措施。 绝经妇女正确使用绝经激素治疗,总体是安全的,但有几个安全性问题值得关注。(1)子宫内膜癌:妇女长期只补充雌激素,证实可能增加子宫内膜癌的风险。妇女应用雌激素治疗时须联合应用孕激素。(2)乳腺癌:国际绝经学会最新推荐,乳腺癌的相关因素很多,与绝经激素治疗相关的乳腺癌风险很低,小于每年1/1000,且应用5年内没有发现乳腺癌风险增加。美国妇女健康倡议(Women's Health Initiative,WHI)研究中,单用雌激素超过7年,乳腺癌风险也没有增加,但雌激素加孕激素组5年后乳腺癌风险有所增加。乳腺癌是绝经激素治疗的禁忌症。(3)心血管病疾病:绝经激素治疗不用于心血管疾病的预防。无心血管病危险因素的女性,60岁以前或绝经不到10年开始激素治疗,可能对其心血管有一定的保护作用;已有心血管损害,或60岁后再开始激素治疗,则没有此保护作用。(4)血栓:绝经激素治疗轻度增加血栓风险。血栓是激素治疗的禁忌证。(5)体质量增加:雌激素为非同化激素,常规剂量没有增加体质量的作用。只有当大剂量使用时才会引起水钠潴留、体质量增加。 4. 选择性雌激素受体调节剂类(selective estrogen receptor modulators,SERMs) SERMs不是雌激素,而是与雌激素受体结合后,在不同靶组织导致受体空间构象发生不同改变,从而在不同组织发挥类似或拮抗雌激素的不同生物效应。如SERMs制剂雷洛昔芬在骨骼与雌激素受体结合,发挥类雌激素的作用,抑制骨吸收,增加骨密度,降低椎体骨折发生的风险;而在乳腺和子宫则发挥拮抗雌激素的作用,因而不刺激乳腺和子宫,有研究表明其能够降低雌激素受体阳性浸润性乳癌的发生率。雷洛昔芬药物总体安全性良好。国外研究报告该药轻度增加静脉栓塞的危险性,国内尚未见类似报道。 5. 甲状旁腺素类似物(parathyroid hormonean alogue,PTHa) PTHa是当前促骨形成的代表性药物,国内已上市的特立帕肽是重组人甲状旁腺素氨基端1-34活性片段(recombinant human parathyroid hormone1-34,rhPTH1-34)。间断使用小剂量PTHa能刺激成骨细胞活性,促进骨形成,增加骨密度,改善骨质量,降低椎体和非椎体骨折的发生风险。 患者对rhPTH1-34的总体耐受性良好。临床常见的不良反应为恶心、肢体疼痛、头痛和眩晕。在动物实验中,大剂量、长时间使用特立帕肽增加大鼠骨肉瘤的发生率。但该药在美国上市后7年骨肉瘤监测研究中,未发现特立帕肽和人骨肉瘤存在因果关系。特立帕肽治疗时间不宜超过24个月,停药后应序贯使用抗骨吸收药物治疗,以维持或增加骨密度,持续降低骨折风险。 6. 补钙制剂 补钙制剂剂型很多,有片剂、胶囊、颗粒剂、粉剂、溶液剂、针剂等等,对于吞咽功能稍差的可以选用颗粒剂、溶液剂或粉剂;对于不能吞咽或禁食的可以用针剂。钙剂还可分为有机钙和无机钙,有机钙溶解度较高,胃肠吸收比较好,也不容易引起胃肠道的消化反应;无机钙含钙量高,可以达到比较好的补钙效果,但无机钙的溶解度较低,对胃肠道的刺激性较大,患者容易出现腹胀、便秘等问题。 维生素D有普通维生素D、单羟维生素D和双羟维生素D。在体内,普通维生素D可以通过机体自身的一羟和二羟的过程转化成能够被机体合理运用的活性维生素D,但对于老年人、户外活动少、原发病、长期激素治疗的患者,尽量选用单羟或双羟维生素D,严重肝肾功能异常的病人应选用双羟维生素D。钙剂和维生素D的复合剂型,适用于普通成年人预防骨质疏松。 7. 雷尼酸锶 该药物具有双重药理作用,用于治疗和预防绝经后的骨质疏松,以降低椎体及髋部骨折的发生,它的最大特点是对胃肠道无刺激作用。 抗骨质疏松药物治疗的成功标志是骨密度保持稳定或增加,而且没有新发骨折或骨折进展的证据。对于正在使用抑制骨吸收药物的患者,治疗成功的目标是骨转换指标值维持在或低于绝经前妇女水平。患者在治疗期间如发生再次骨折或显著的骨量丢失,则需考虑换药或评估继发性骨质疏松的病因;如果治疗期间发生一次骨折,并不能表明药物治疗失败,但提示该患者骨折风险高。 除双膦酸盐药物外,其他抗骨质疏松药物一旦停止应用,疗效就会快速下降,双膦酸盐类药物停用后,其抗骨质疏松性骨折的作用可能会保持数年。另外,由于双膦酸盐类药物治疗超过5年的获益证据有限,而且使用超过5年,可能会增加罕见不良反应(如下颌骨坏死或非典型股骨骨折)的风险。目前建议口服双膦酸盐治疗5年,静脉双膦酸盐治疗3年,应对骨折风险进行评估,如为低风险,可考虑实施“药物假期”,停用双膦酸盐;如骨折风险仍高,可以继续使用双膦酸盐或换用其他抗骨质疏松药物(如特立帕肽或雷洛昔芬)。特立帕肽疗程不应超过两年。 抗骨质疏松药物疗程应个体化,所有治疗应至少坚持1年,在最初3~5年治疗期后,应该全面评估患者发生骨质疏松性骨折的风险,包括骨折史、新出现的慢性疾病或用药情况、身高变化、骨密度变化、骨转换生化指标水平等。 五、消化内镜检查前的用药注意事项消化内镜检查前,医师需要评估患者的身体状态,了解患者的用药情况,以 便能安全顺利地进行检查,那么,消化内镜检查前用药应有哪些注意事项? 1.抗栓药物 随着人口老龄化,老年疾病尤其是心脑血管疾病发病率明显增加,老年患者应用抗栓药物比例明显增加。抗栓药物包括抗血小板药物和抗凝药物。因年龄的增长,消化道肿瘤的发病率也显著上升,消化道内镜已广泛用于消化道肿瘤的筛查,越来越多正在服用抗栓药物的老年心脑血管疾病患者接受消化道内镜检查。 消化道内镜医师为避免消化道出血风险,倾向于在内镜检查前停用抗栓药物,但是,患者中断抗栓药物治疗,却可能有导致心脑血管血栓栓塞事件增加的风险。因此,能否停用抗栓药物主要取决于相关内镜操作的出血风险和停用抗栓药物的栓塞风险。对于出血风险,欧美指南将相关操作分为出血高危内镜操作(如括约肌切开术)和出血低危内镜操作(如诊断性检查术)。 服用华法林的患者,美国指南建议进行低危性内镜操作时,不必调整抗凝药物剂量;对于高危性操作,应预先停用华法林4~5d,同时可给予低分子肝素进行过渡性治疗。应用低分子肝素患者,低危操作时不需改变原治疗方案,高危操作时,检查前至少停药8h,如需快速逆转其作用,可静脉给予硫酸鱼精蛋白,但应注意硫酸鱼精蛋白可能引起低血压和过敏反应。 服用抗血小板药物的患者,低危操作指南均推荐无须停用阿司匹林。欧美及日本指南均推荐无须停用噻吩并吡啶类药物,噻吩并吡啶类药物是以二磷酸腺苷受体为靶点的一类抗血小板药物,包括噻氯匹定、氯吡格雷和普拉格雷。高危操作时,是否需要停药仍不能确定,如需停药应在检查前7~10d停药,内镜检查后可立刻重新用药。选择内镜检查前联合应用氯吡格雷和阿司匹林的患者,可考虑改用单一用药。 2. 抗高血压药物 内镜检查前一天晚上要求少渣或无渣流质饮食,内镜检查前禁饮食,避免进食刺激消化道分泌物增多。肠镜在清肠后4~6h内进行,避免时间过长导致消化道分泌物排至结肠,继而影响肠道准备的效果。 必须服用抗高血压药物的患者,可于前一日晚服用长效的降压药物,也可考虑于当日检查前舌下含服卡托普利片,防止检查过程中因血压高发生不良事件,也避免出现口服药物时由相关辅料引起的视野不清。 3. 肠道清洁剂 肠道准备是下消化道内镜检查操作的通行证,如果肠道准备不够理想,可能影响观察效果,出现漏诊、误诊等,还需再次清肠重复检查,增加费用负担。因此,肠道清洁剂的正确使用是下消化道内镜检查前的一项关键操作。我院目前有复方聚乙二醇电解质散和磷酸钠盐口服液两种。(1)复方聚乙二醇电解质散的服用方法是:可以将整包药物(137.15g)置于带有刻度的水杯中,加入2000ml温开水,溶解后饮服,首次服用600~1000ml,每隔10-15分钟喝一次(250ml/次),全部药液尽量在1小时内服完。如果患者不能耐受,可在2~3h内服完。(2)磷酸钠盐口服液(90ml)用于肠道准备时应该分两次服药,每次服用45毫升,两次服药间隔10-12小时。第1次服用是在检查前一天晚上7点,将45毫升药液置于带有刻度的水杯中,加入750毫升温开水,摇匀后服用。第2次服用是在检查当日早晨3点(上午做检查)或7点(下午做检查),将45毫升药液置于带有刻度的水杯中,加入750毫升温开水,摇匀后服用。需要注意的是:服药后可以适当的运动,如来回走动;也可以脐部为中心,顺时针按摩腹部或点击按压腹部,促进肠蠕动,利于排便。如果服药过程中出现以下不耐受的现象:如恶心、呕吐、腹胀等,这是药物的正常不良反应,停药即可消失;但也可能是药物的服用方式不正确所致,如饮水过多导致腹胀,药液浓度过高或服药速度过快可能导致恶心、呕吐,药液浓度过低或服药速度过慢可能导致水分被肠道吸收,进而影响清洁效果。为了争取诊疗的时间、诊疗的质量,应该正确服用肠道清洁剂。但是,目前临床上对于肠道清洁剂的服用方式(一次性服还是分次服)、服用速度(1h、2h还是3h服完)及与检查间隔时间(4h、6h还是大于6h)仍未达成一致的建议和共识,仍需大量的高质量临床研究来证实。 4. 祛泡剂 内镜检查前黏膜附着的泡沫会影响观察,据报道32%~57%的患者会在结肠镜检查中会遇到泡沫。应用消泡剂,主要是为了减少泡沫,提高视野清洁度。目前有二甲硅油散(聚二甲基硅氧烷,是长链的硅酮聚合物)和西甲硅油散(聚二甲基硅氧烷和二氧化硅的混合物,也称为二氧化硅二甲硅油)。有研究显示,二氧化硅能增强二甲硅油的消泡作用,二甲硅油和二氧化硅的混合物5mg(二甲硅油4.7mg,二氧化硅0.3mg)消泡能力与750mg二甲硅油的消泡能力相当。有研究表明胃镜检查前30min服用二甲硅油散,具有较好的消泡结果。肠道准备完成后,肠镜检查前1h服用具有较好的消泡结果。其实目前临床上对于服用祛泡剂的的服用方式(单独口服还是和灌肠液混用)及服用时间也未达成共识,仍需高质量的大样本试验研究。指南建议二甲基硅油120~240mg或西甲硅油3-6ml或30%溶液45ml,可与泻药给药时一起使用。 六、为什么注射用兰索拉唑需要专用输液器?兰索拉唑是继奥美拉唑之后的一种质子泵抑制剂,对于组胺、胃泌素和乙酰胆碱等因素刺激引起的胃酸分泌,具有起效快、治愈率高、不良反应轻微等优点,目前广泛应用于临床。但注射用兰索拉唑需要专用一次性使用孔径为1.2 μm精密过滤输液器,其原因为何? 注射用兰索拉唑于2004年5月被FDA批准上市,共有3版说明书,两次都对其注射使用方法中关于过滤输液器的说明进行了修改,从需要使用(Request)到必须使用(Must)厂家提供的输液器(图1),避免输液中微粒进入血管。国内的多个注射用兰索拉唑冻干粉说明书也都提到,输液时应使用配有孔径为1.2μm的过滤器(图2),以除去输液过程中可能产生的不溶性微粒,这些微粒导致的沉淀可能引起小血管栓塞而产生严重后果。 
图1. 注射用兰索拉唑冻干粉FDA说明书部分内容 
图2. 某注射用兰索拉唑冻干粉说明书部分内容
为什么注射用兰索拉唑冻干粉复溶、混合调配后易产生不溶性微粒?通过Drugbank检索到,兰索拉唑本身的溶解度很低,约为0.97 mg/L,几乎不溶于水(Practically insoluble);奥美拉唑与艾司奥美拉唑微溶于水(Slightly soluble),溶解度约为0.5 mg/mL,泮托拉唑较易溶于水(Freely soluble)。FDA说明书显示,注射用兰索拉唑需要按3:1比例添加葡甲胺,葡甲胺是一种有机碱,在药物制剂中常被用作增溶剂,在酸性条件下与阳离子药物形成络合物,可以提高药物的溶解度。在使用时需要控制制剂中葡甲胺的含量,以此来提高兰索拉唑的溶解度。但兰索拉唑-葡甲胺络合物的稳定性受温度影响明显,兰索拉唑冻干粉制备过程中温度波动可从-48oC至40oC,且制剂中加入了NaOH,溶液为强碱性,可能导致少部分络合物的分离,复溶时大多使用的是0.9%氯化钠注射液,与冻干前的溶液体系不同,而兰索拉唑几乎不溶于水,因此易产生不溶性微粒。另外,注射用兰索拉唑调配后稳定性差,随时间推移至滴注结束溶液pH值下降也容易析出微粒。微粒增加引起静脉炎和其他不良反应的机会也相应增大。 为了确保患者的用药安全性,减少注射用兰索拉唑中不溶性微粒对患者造成的潜在危害或直接的危害,在使用注射用兰索拉唑时应严格按要求使用一次性使用1.2μm精密过滤输液器,有效过滤微粒,确保注射用兰索拉唑的药液质量,在实现治疗作用的同时,减少不良反应,确保患者用药安全。 |
地址:山东省淄博市高新区柳泉路111号火炬广场D座1210室
电话:13792168866,13506433058
邮箱:Zbsysxh926@163.com
版权所有:淄博市药师协会 Copyright © 2022 www.zbsysxh.org.cn All Rights Reserved.
网站备案编号:鲁ICP备2022018695号-1 技术支持:亿泰信息